Karina Toledo, de Shenzhen | Agência FAPESP – Pesquisadores do Instituto Butantan e colaboradores estão desenvolvendo uma versão mais potente da vacina BCG, que protege contra a tuberculose. Enquanto o imunizante convencional reduziu em 90% a infecção nos experimentos com camundongos, com a chamada BCG recombinante o índice de proteção subiu para 99%. Além disso, a nova formulação protegeu os animais por um período significativamente mais longo.
“A BCG é a primeira vacina que recebemos ao nascer e ela de fato é efetiva na proteção de crianças. Mas a imunidade contra a doença tende a cair na vida adulta e, como as bactérias estão se tornando resistentes aos antibióticos, ninguém está seguro. Tem sido feito um esforço mundial para tentar melhorar a prevenção da tuberculose pulmonar adulta. Hoje são registrados cerca de 10 milhões de novos casos e 1,5 milhão de mortes por ano no mundo”, diz à Agência FAPESP Luciana Cezar de Cerqueira Leite, pesquisadora do Laboratório de Desenvolvimento de Vacinas do Butantan apoiada pela FAPESP.
Para entender por que a BCG recombinante leva a uma resposta imune mais intensa e duradoura, o grupo do Butantan e colaboradores de diversos países têm adotado uma abordagem conhecida como biologia de sistemas – que resumidamente consiste em observar no modelo animal o comportamento de milhares de genes, em diferentes tecidos (principalmente pulmão e linfonodos), ao longo de toda a montagem da resposta imune. Tal empreitada envolve o sequenciamento de centenas de amostras, seguido por um intenso trabalho de bioinformática e mineração de dados.
O tema foi abordado por Cerqueira Leite no dia 29 de junho, durante palestra apresentada na FAPESP Week China. O painel, dedicado a temas de saúde e biomedicina, também contou com a participação de Zhang Zhiyong, da Universidade de Medicina de Guangzhou; Pedro Moraes-Vieira, da Universidade Estadual de Campinas (Unicamp); Xin Jin, cientista-chefe de Pesquisa da empresa chinesa BGI; e Dan Zhang, cofundador da empresa Hillgene BioPharma, também da China. Os mediadores foram Xin Jin (BGI) e Simone Appenzeller (Unicamp).
“A gente sequenciou todo o RNA que foi expresso e está presente em amostras coletadas em vários momentos: antes de o animal ser imunizado, sete e 90 dias após a imunização – quando é feito o desafio [a bactéria é inoculada no nariz dos roedores] – e sete e 90 dias após o desafio”, conta Cerqueira Leite.
Foram comparadas amostras de três grupos de camundongos: um não imunizado, outro que recebeu a BCG convencional e um terceiro vacinado com a BCG recombinante. Em cada momento de análise, foram comparados quais genes estavam com a expressão aumentada ou diminuída nos diferentes grupos.
“Já com sete dias de imunização foi possível ver uma mudança bem grande no grupo que recebeu a versão recombinante: cerca de 200 genes já estão sendo ativados, enquanto no grupo da BCG convencional ainda não estava acontecendo quase nada. Depois de 90 dias, a resposta à BCG convencional já começa a cair, enquanto no grupo recombinante ela se mantém. Mas a grande novidade é que as duas vacinas atuam por caminhos metabólicos bem diferentes e nós conseguimos mapeá-los. Os dados serão publicados em breve”, revela a pesquisadora.

Luciana Cezar de Cerqueira Leite, do Instituto Butantan, durante palestra apresentada na FAPESP Week China (foto: Karina Toledo/Agência FAPESP)
Bactéria turbinada
Onipresente nas maternidades brasileiras, a vacina BCG foi criada há mais de cem anos a partir da atenuação da bactéria causadora da tuberculose bovina (Mycobacterium bovis), que é muito parecida com a da tuberculose humana (M. tuberculosis).
Já a versão recombinante “ganhou”, por engenharia genética, a capacidade de produzir um fragmento de uma toxina originalmente secretada pela Escherichia coli, espécie bacteriana comumente presente no intestino humano.
“Algumas bactérias E. coli produzem toxinas sensíveis ao calor, conhecidas pela sigla LT [do inglês heat-labile toxin], que são altamente imunogênicas, isto é, induzem uma forte resposta do sistema imune. Na vacina recombinante nós usamos um fragmento detoxificado LT [denominado LTAK63]. Ele não é capaz de causar doença, mas mantém a imunogenicidade, então funciona como um adjuvante da vacina BCG”, explica Cerqueira Leite.
Segundo a pesquisadora, os primeiros estudos usando a estratégia de BCG recombinante visavam o desenvolvimento de uma vacina neonatal contra a coqueluche. “Isso porque a BCG pode ser dada ao nascimento, enquanto o imunizante atualmente disponível contra a coqueluche [a vacina tríplice bacteriana, ou DTP] só oferece proteção a partir dos seis meses de idade. Nesse caso, usamos um fragmento da toxina produzida pela bactéria da coqueluche [Bordetella pertussis]”, relata.
Diante dos resultados promissores, a mesma plataforma vem sendo empregada na busca de novas e melhores vacinas contra coqueluche, tuberculose, pneumonia (causada por Streptococcus pneumoniae ou pneumococo) e esquistossomose, bem como no tratamento do câncer de bexiga (caso em que se usa a vacina para “acordar” o sistema imune, estimulando-o a atacar o tumor).
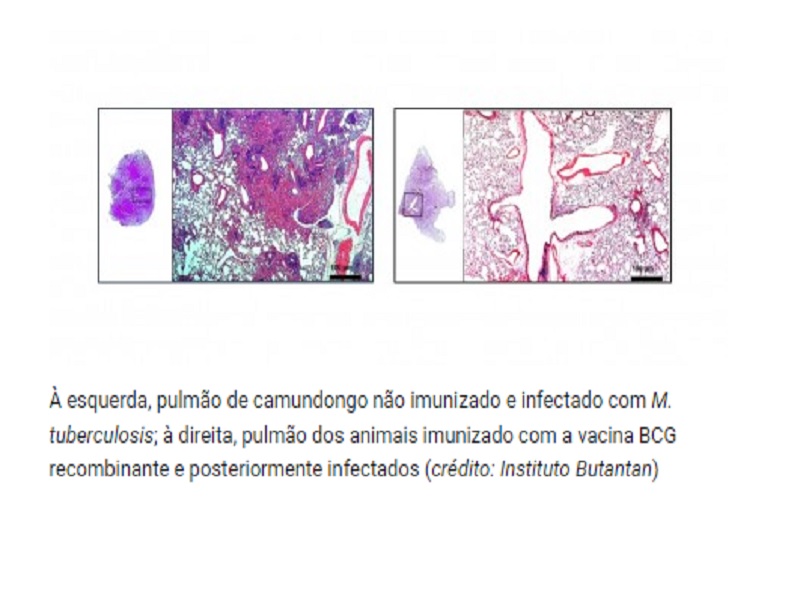
Nos experimentos feitos com o modelo animal de tuberculose, observou-se que a BCG recombinante reduz em cem vezes a quantidade de bactéria no pulmão e também diminui a inflamação no órgão. “Ao tentar matar a bactéria, as células de defesa acabam atacando tudo o que está por perto e causam lesão nos tecidos. Mas o pulmão dos animais imunizados com a BCG recombinante é branquinho, menos inflamado. Agora, ao detalhar o mecanismo de ação das duas vacinas, a gente entende por que isso acontece”, diz Cerqueira Leite.
Toda a parte de sequenciamento de RNA foi conduzida em Shenzhen, na China, pela empresa BGI, que presta serviços de genômica para laboratórios de todo o mundo. Colaboraram nos estudos pesquisadores do Shenzhen Institute of Advanced Technology, da Universidade de São Paulo (USP), Faculdade Israelita de Ciências da Saúde Albert Einstein, Fundação Oswaldo Cruz (Fiocruz) da Bahia, das farmacêuticas Novartis e GSK, do Institut Pasteur e da Universidade Federal de Goiânia (UFG), entre outros parceiros.
Antes de iniciar os estudos clínicos, o grupo pretende fazer mais uma rodada de testes em bovinos. Segundo Cerqueira Leite, a expectativa é que produção dos lotes experimentais do imunizante ocorra em 2025 e que os ensaios comecem no ano seguinte. “Em humanos poderíamos iniciar em seguida, mas será mais caro e precisaremos conseguir o financiamento.”
Para saber mais sobre a FAPESP Week China acesse: fapesp.br/week/2024/china.

