
Tão presente em tarefas cotidianas, como na indicação da melhor rota de trânsito, na escolha do pacote de viagem mais barato e em serviços de atendimento ao cliente, a inteligência artificial (IA) começa a chegar à área da saúde. A Organização Mundial da Saúde (OMS) a classifica como uma grande promessa para melhorar a prestação de serviços de saúde em todo o mundo. Para a organização, ela pode ser utilizada – e em alguns países ricos já é – para melhorar a velocidade e a precisão do diagnóstico e da triagem de doenças, auxiliar no atendimento clínico e fortalecer a pesquisa em saúde e o desenvolvimento de medicamentos. Também pode apoiar diversas ações de saúde pública, como vigilância de doenças e gestão de sistemas de saúde.
Inteligência artificial pode ser entendida como a capacidade de dispositivos eletrônicos reproduzirem a forma humana de perceber situações variáveis, fazer escolhas e solucionar problemas. O software é a parte lógica do dispositivo, o “cérebro”. Ele é composto por diversas sequências de instruções que orientam seu funcionamento, os algoritmos. Inicialmente, os algoritmos seguiam apenas programações prévias, mas hoje são treinados para reconhecer padrões sozinhos com base nos dados com os quais trabalham. É o chamado aprendizado de máquina (ver glossário com termos técnicos).
Glossário
Algoritmo: modelo computacional que define precisamente a transformação de dados de entrada em dados de saída.
Inteligência artificial: conjunto de técnicas para resolução de problemas, que compreendem automação de raciocínio dedutivo, técnicas probabilísticas, aprendizado de máquina, entre outras.
Machine learning (aprendizado de máquina): técnica de inteligência artificial em que um modelo computacional é obtido a partir da apresentação de dados a um programa, muitas vezes associado a uma resposta esperada. Ao longo de diversas interações, o modelo tende a aproximar as respostas apresentadas nos dados de treinamento ao aprender os valores de uma série de parâmetros. Cada método de aprendizado automático define quais são os parâmetros a serem aprendidos e como eles transformam as entradas em saídas.
Deep learning (aprendizado profundo): técnica moderna de aprendizado de máquina composta pela concatenação de diversos módulos (camadas) de aprendizado que cooperam entre si. Esse tipo de modelo de aprendizado contém um elevado número de parâmetros a serem aprendidos e requer uma grande quantidade de dados para seu treinamento.
Big data: técnica de tratamento de grandes quantidades de dados, frequentemente associada a deep learning.
Transfer learning (transferência de aprendizado): modalidade de aprendizado automático em que parte do treinamento é realizada num domínio e, posteriormente, adaptada e/ou transferida para outro domínio. A primeira parte, em que o algoritmo aprende a completar conjuntos de dados parcialmente apresentados, é geralmente desenvolvida de forma autossupervisionada, ou seja, sem dados de saída. A segunda parte consiste em um refinamento para um conjunto específico de entradas e saídas.
Fontes Marcelo Finger (USP) e Alexandre Falcão (Unicamp)
A ideia é que o algoritmo possa acessar e assimilar uma grande quantidade de dados, encontrar padrões e apontar soluções de forma mais rápida e com um maior índice de acerto do que os humanos. Especialistas destacam que essa área exige profissionais bem preparados e lembram que os sistemas de IA não estão sendo desenvolvidos para substituir os médicos. “O propósito é usar a grande capacidade de analisar informações da IA como aliada do médico na tomada de decisão”, diz o economista e professor de inteligência artificial em saúde Alexandre Dias Porto Chiavegatto Filho, diretor do Laboratório de Big Data e Análise Preditiva em Saúde (Labdaps), criado em 2017 na Faculdade de Saúde Pública da Universidade de São Paulo (USP), com apoio da FAPESP.
O grande investidor em pesquisa em IA na saúde no mundo é a multinacional de tecnologia Alphabet, do grupo Google. O Instituto de Tecnologia de Massachusetts (MIT) e as universidades Stanford e Harvard, nos Estados Unidos, e as de Oxford e Cambridge, no Reino Unido, também se destacam. No Brasil, USP, Universidade Estadual de Campinas (Unicamp) e Universidade Federal de Minas Gerais (UFMG) estão entre as que mais se dedicam a esse campo de pesquisa.
De acordo com o relatório “Artificial intelligence index report 2022”, da Universidade Stanford, foram investidos pelo setor privado em todo o mundo US$ 11,3 bilhões em pesquisa e inovação com IA para medicina e saúde em 2021, um aumento de 40% em relação ao ano anterior. Nos últimos cinco anos, os recursos somaram US$ 28,9 bilhões, o que posicionou o segmento como o maior receptor de investimentos privados em IA, superando atividades tradicionais no uso de tecnologias da informação, como o setor financeiro e o varejo. A visão computacional, segmentando imagens de órgãos, lesões ou tumores, foi uma das aplicações que despertaram mais interesse na comunidade médica.
Um dos desenvolvimentos de IA com maior repercussão é o software AlphaFold, criado pela empresa DeepMind, pertencente ao Google. O programa, eleito pela revista científica Science como a descoberta do ano de 2021, usa técnicas de deep learning (aprendizado profundo) em modelos de ensaios moleculares para resolver o problema chamado de “dobramento de proteínas”. Proteínas consistem em cadeias de aminoácidos que se dobram espontaneamente e formam estruturas tridimensionais (3D) – sua forma 3D tem relação direta com a função biológica que desempenha. Por esse motivo, entender como se formam as estruturas das proteínas pode encaminhar soluções que vão desde o entendimento da base celular da vida à descoberta de drogas e cura de doenças. No caso do AlphaFold, os pesquisadores só precisam informar a sequência de aminoácidos que define determinada proteína e o programa apresentará sua estrutura dobrada. Mais de meio milhão de pesquisadores já acessaram o programa para criar soluções que vão do enfrentamento à poluição dos plásticos ao entendimento sobre o que leva à resistência aos antibióticos.
Desafios pela frente
Apesar dos volumosos investimentos que recebe e dos avanços recentes, desafios técnicos, éticos e legais ainda precisam ser superados para uma maior disseminação dessas ferramentas. Uma das preocupações recai sobre a responsabilidade civil em razão de falhas de diagnóstico que envolvem softwares e algoritmos de IA. Outra diz respeito ao uso antiético de informações, seja pela exposição de dados que violem a privacidade dos pacientes ou pelo emprego de algoritmos que reforcem preconceitos e perpetuem desigualdades no acesso à saúde (ver box).
Especialistas também ponderam que a IA ainda precisa conquistar a confiança da comunidade médica para ser vista como uma técnica segura. “É uma tarefa na qual ainda estamos no início. A tecnologia de IA ainda vai demorar até ser incorporada em grande escala na saúde no Brasil e no mundo”, avalia Chiavegatto. O primeiro desafio a ser superado é a qualidade da informação que alimenta os algoritmos. O sistema de saúde gera muitos dados, mas pouca informação consolidada. “Dados incompletos e inconsistentes geram algoritmos ruins”, diz o pesquisador.
Uma sugestão equivocada proveniente de um sistema de IA para uma rota no trânsito ou de um filme no streaming gera aborrecimento. Na saúde, pode induzir o médico a erro e assim colocar uma vida em risco. Caberá a cada novo sistema de IA desenvolvido na área médica demonstrar a consistência de seus algoritmos para gerar a necessária confiança.
O segundo desafio da ciência de computação é demonstrar que a IA é efetiva, ou seja, melhora as práticas clínicas. “Ainda não existem demonstrações científicas de que uma prescrição médica receitada com o auxílio de IA, por exemplo, gere um tratamento mais adequado”, afirma Chiavegatto.
Uma das linhas de trabalho do Labdaps é sobre a seleção de dados para o treinamento de algoritmos. Um estudo recente do laboratório concluiu que algoritmos treinados com dados locais possuem desempenho superior aos algoritmos que usam uma base ampla de informação coletada em populações com perfis genéticos e socioeconômicos diferentes.
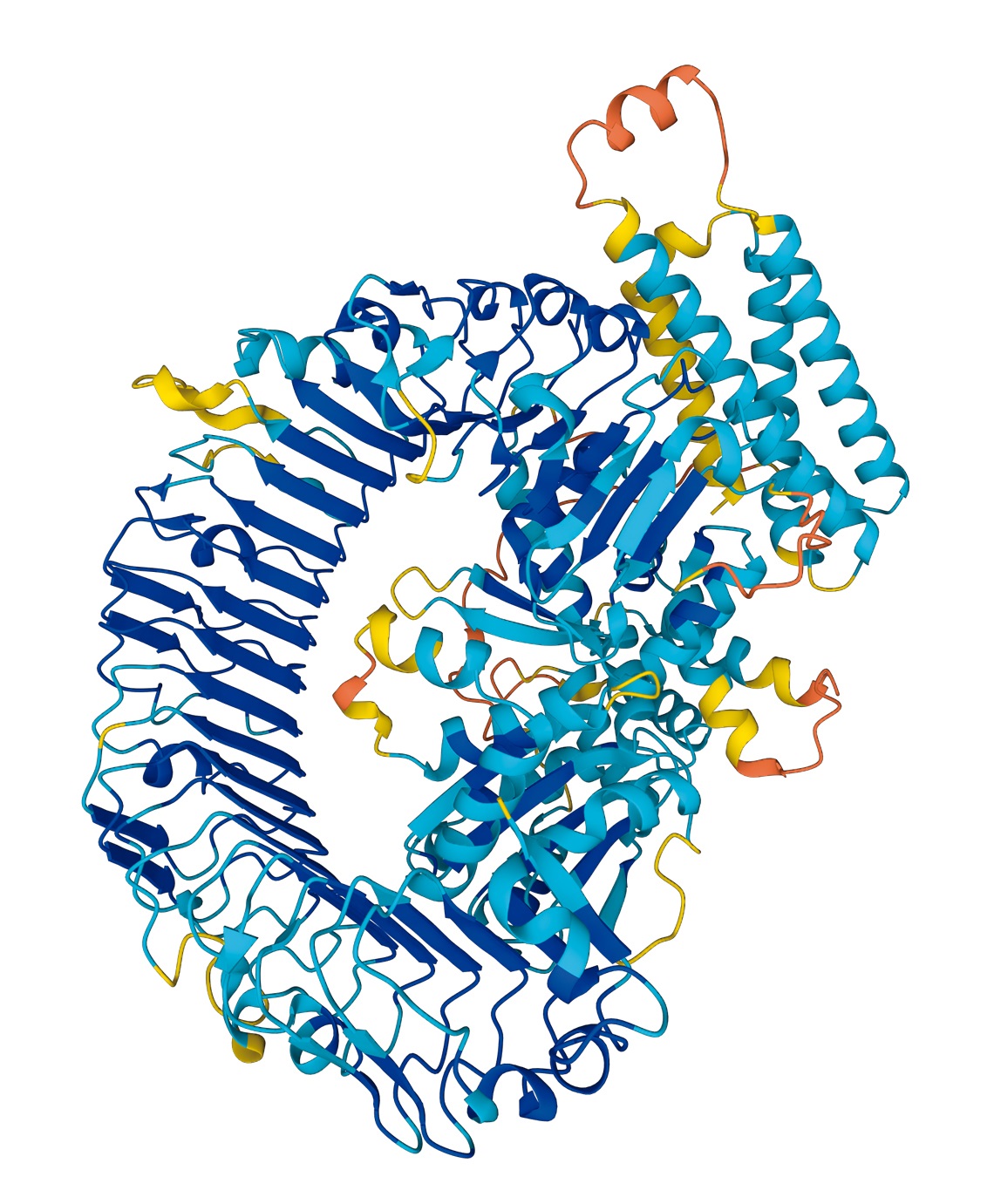
Deep Mind / AlphaFoldEstrutura tridimensional de proteínas, feita pelo programa de inteligência artificial AlphaFoldDeep Mind / AlphaFold
O estudo teve como base o desenvolvimento de algoritmos com a finalidade de prever a mortalidade em pacientes vítimas de Covid-19. Foram coletados dados de 16.236 pessoas de 18 hospitais de diferentes regiões do Brasil entre março e agosto de 2020. Com a informação em mãos, os pesquisadores testaram oito estratégias diferentes para o desenvolvimento de modelos preditivos. Os melhores desempenhos foram obtidos com aqueles que usaram dados locais, enquanto a adição de dados de pacientes de outras regiões diminuía a capacidade de previsão.
“Demonstramos que um algoritmo treinado em São Paulo pode não ser a melhor solução de IA a ser aplicada em Belém ou em Salvador”, explica Chiavegatto. Um artigo sobre o estudo já foi submetido a uma revista científica. “É um tema de interesse global. Muitos algoritmos desenvolvidos em um país terão que ser retreinados com técnicas de transfer learning”, prevê o especialista. Transfer learning – ou transferência de aprendizado – é um problema de pesquisa em aprendizado de máquina que se concentra em armazenar o conhecimento adquirido ao resolver um problema e aplicá-lo a um problema diferente, mas relacionado.
Uma iniciativa recente para ampliar os investimentos em IA em saúde no país veio de uma parceria entre a FAPESP, o Ministério da Ciência, Tecnologia e Inovações (MCTI), o Ministério das Comunicações e o Comitê Gestor da Internet no Brasil (CGI.br). Por meio de uma chamada pública concluída em 2021, foram constituídos seis Centros de Pesquisas Aplicadas (CPA) em inteligência artificial com foco não apenas no setor da saúde, mas também na agricultura, na indústria e em cidades inteligentes. Cada centro receberá R$ 1 milhão por ano por até 10 anos e um valor idêntico será aportado por parceiros privados, totalizando até R$ 20 milhões por unidade de pesquisa.
Dois dos novos CPA vão atuar especificamente com foco na saúde e reúnem pesquisadores que já desenvolvem soluções de IA no setor. Em Belo Horizonte (MG), o Centro de Inovação em Inteligência Artificial para a Saúde (Ciia-Saúde), sediado na UFMG, reúne mais oito instituições e quatro empresas parceiras. Irá atuar em cinco eixos temáticos: prevenção e qualidade de vida; diagnóstico, prognóstico e rastreamento; medicina terapêutica e personalizada; sistemas de saúde e gestão; e epidemias e desastres. “Vamos fazer a primeira chamada de projetos até o final do ano”, diz o médico e vice-diretor do Ciia Antônio Luiz Pinho Ribeiro, que também coordena o Centro de Telessaúde do Hospital das Clínicas da UFMG.
O Centro de Telessaúde realiza por volta de 4 mil eletrocardiogramas (ECG) por dia e os dados coletados serviram de base para o desenvolvimento de duas pesquisas de IA na área de doenças cardiovasculares que renderam artigos publicados no periódico científico Nature Communications. No primeiro, publicado em 2020, a equipe de pesquisa do Telessaúde apresentou um sistema de diagnóstico automático do ECG padrão, denominado ECG de 12 derivações, capaz de reconhecer seis tipos de anormalidades, utilizando deep learning, o aprendizado de máquina profundo. A sensibilidade do método, ou seja, a capacidade de apontar corretamente quando o paciente está doente, foi de 80%, e a especificidade, isto é, o acerto quando o indivíduo não apresenta a doença, maior ainda, de 99%.
O segundo artigo, publicado em 2021, apresentou um estudo que utilizou a IA para criar uma medida de saúde cardiovascular, o ECG-idade. O sistema faz uma análise do ECG e determina a idade provável do indivíduo com base na saúde de seu coração. Indivíduos com ECG-idade superior à sua idade cronológica, em teoria, têm maior risco de mortalidade gerada por problemas cardiovasculares. “É uma informação que pode ser utilizada na predição e no acompanhamento médico”, conta Ribeiro. “Mas o sistema de IA não está pronto para uso comercial, pois ainda é preciso validar se a informação de fato contribui para a conduta médica e o bem-estar do paciente.”
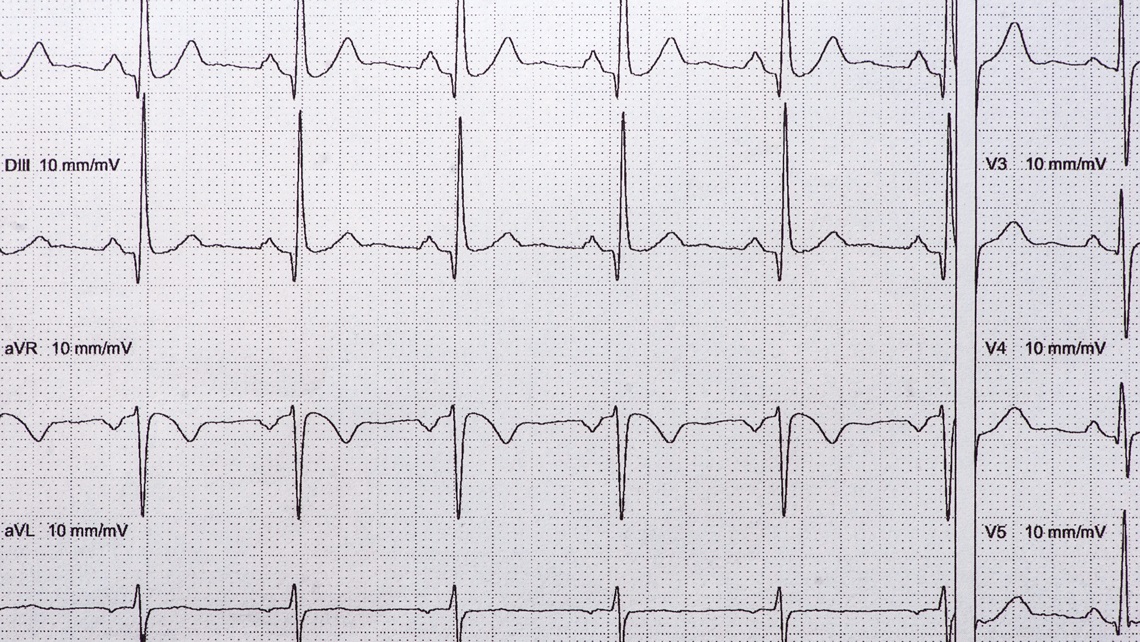
Léo Ramos Chaves / Revista Pesquisa FAPESPExame de eletrocardiograma: análise por IA pode determinar idade do pacienteLéo Ramos Chaves / Revista Pesquisa FAPESP
O outro CPA é o Brazilian Institute of Data Science (Bios). Coordenado pela Unicamp, reúne 12 parceiros públicos e privados e está em fase de implementação. O Bios atuará nas áreas da saúde, agronegócio e método, ou seja, no desenvolvimento de pesquisa aplicada em ciência de dados para vários segmentos de atividades. Segundo o médico obstetra e docente da Unicamp Rodolfo Pacagnella, coordenador na área da saúde do Bios, três linhas de pesquisas já estão definidas: saúde da mulher, diagnóstico de câncer de pele e diagnóstico de câncer de pulmão. O câncer de pele é um dos tumores de maior incidência no mundo e a cientista de computação Sandra Eliza Fontes de Ávila, do Instituto de Computação da Unicamp, desenvolveu um software capaz de detectar câncer do tipo melanoma, o mais agressivo dos tumores (ver Pesquisa FAPESP nº 305).
Na área da saúde da mulher, Pacagnella coordena pesquisas que utilizam IA para reconhecer padrões de riscos de mortalidade materna e nascimentos prematuros e assim estabelecer estratégias preditivas. “Identificar precocemente um problema de saúde permite fazer um acompanhamento e tratamento mais adequado, mas também melhorar a gestão da rede de saúde. Podemos saber, com antecedência, quando precisaremos de vagas em UTIs nas maternidades e equipes médicas de plantão”, exemplifica Pacagnella.
Duas startups apoiadas pela FAPESP desenvolveram tecnologias de IA que já auxiliam o diagnóstico oncológico. A Onkos Diagnósticos Moleculares, graduada no Supera Parque de Inovação e Tecnologia de Ribeirão Preto, no interior paulista, criou um exame genético, o mirTHYpe, para aperfeiçoar a classificação de nódulos de tireoide indeterminados. Em cerca de 25% dos diagnósticos, o exame tradicional, a punção aspirativa (Paaf), não consegue determinar se o tumor é maligno ou benigno. Nesses casos, todos os pacientes, por precaução, são encaminhados para cirurgias diagnósticas, mas 80% delas se demonstram desnecessárias por revelarem nódulos benignos. Os pacientes poderão ter sequelas, como a necessidade de reposição hormonal por toda a vida.
Lançado em 2018, o mirTHYpe faz uma leitura dos microRNAs, pequenas moléculas regulatórias do RNA (ácido ribonucleico) dos nódulos para determinar se a lesão é benigna ou maligna, por meio de inteligência artificial. Com isso, evitam-se cirurgias dispensáveis (ver Pesquisa FAPESP nº 264). Um estudo realizado pela equipe de pesquisa do Onkos com 440 pacientes de 128 laboratórios que já utilizam o método concluiu que o mirTHYpe influenciou 92% das tomadas de decisão médicas e reduziu em 75% as cirurgias dispensáveis. O trabalho foi tema de artigo publicado em agosto deste ano na revista científica The Lancet Discovery Science (eBioMedicine). “Com uma base de dados maior formada nos últimos anos, estamos retreinando nosso algoritmo e acreditamos que podemos evitar até 89% das cirurgias diagnósticas desnecessárias”, diz o biólogo Marcos Tadeu dos Santos, fundador da Onkos.
A inteligência artificial ainda precisa conquistar a confiança da comunidade médica para ser vista como uma técnica segura
A outra startup é a Harpia Health Solutions, sediada no Parque Tecnológico de São José dos Campos (SP). Sua equipe de pesquisadores e desenvolvedores projetou uma plataforma on-line, a Delfos, que hospeda soluções de IA e visão computacional para dar suporte ao diagnóstico de exames de imagens médicas. “Funciona como uma segunda opinião ao radiologista”, diz o mestre em engenharia biomédica Daniel Aparecido Vital, sócio-fundador da Harpia.
Na prática, a plataforma recebe por meio de uma interface de programação de aplicações (API) os exames e responde em até cinco minutos diretamente ao sistema de arquivamento e compartilhamento de imagens de radiologia (Pacs/Ris) em que o radiologista realiza o laudo. Nesse intervalo, a plataforma identifica e classifica automaticamente anomalias e cria um índice de triagem que permite a priorização dos achados anormais a serem diagnosticados. Ao mesmo tempo, insere no sistema uma imagem com indicações visuais das anomalias.
“É um método que gera produtividade e assertividade no diagnóstico ao permitir que o radiologista concentre sua atenção nas anomalias encontradas e reduz erros gerados por cansaço resultante de longas jornadas de trabalho”, afirma Vital. O primeiro serviço disponibilizado é o Delfos Mamografia, que já processou mais de 72 mil exames de mamografia. A Harpia também criou uma solução para raio X de tórax, em fase de validação.
Os recursos de inteligência artificial também vêm sendo usados para melhorar a administração de hospitais. Uma das tecnologias criadas recentemente no país com esse propósito é o Neonpass, que possibilita o acompanhamento integrado de toda a jornada do paciente dentro da unidade de saúde. A inovação, já em uso nos hospitais Sírio-Libanês e Albert Einstein, ambos em São Paulo, foi criada pela Hoobox, apoiada pela FAPESP.
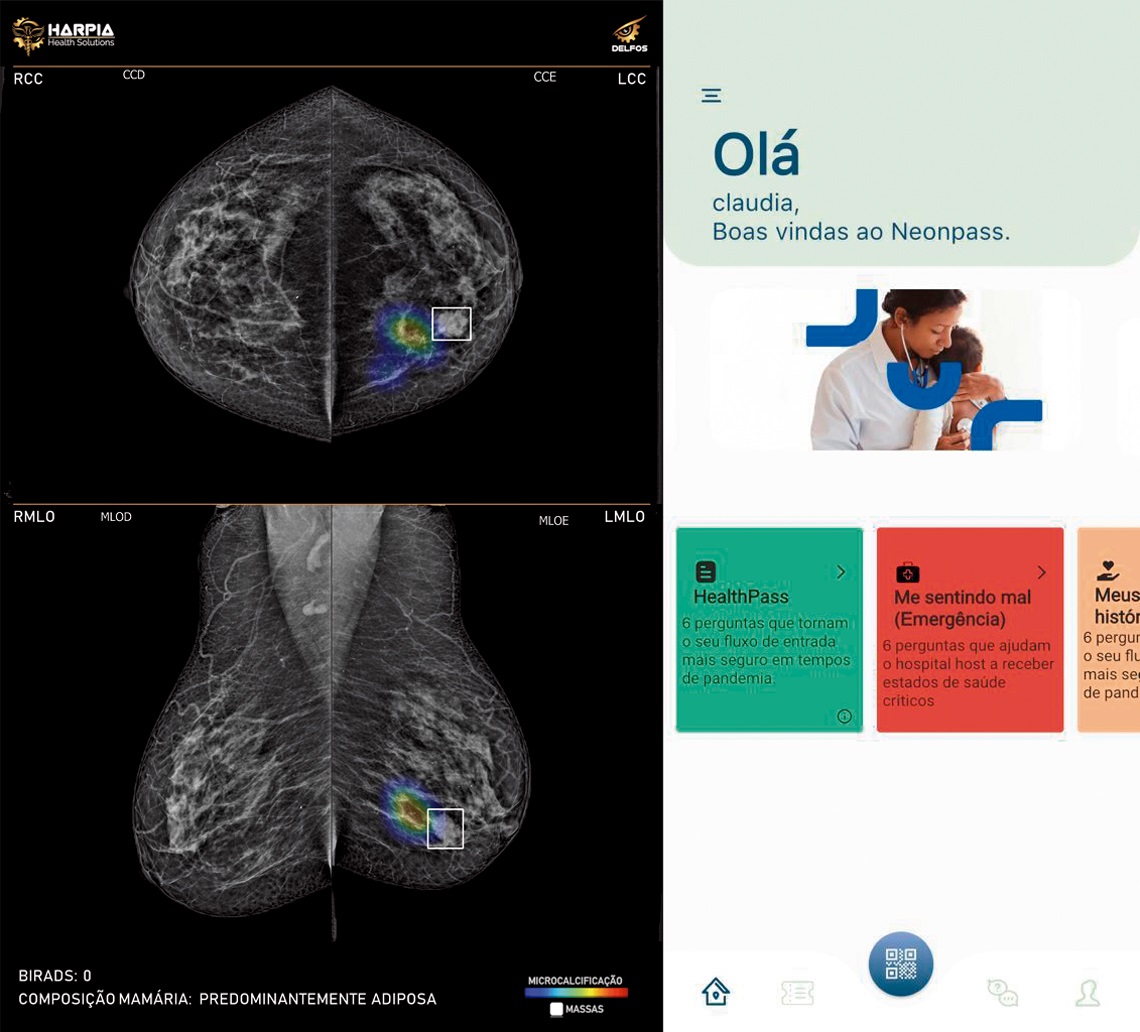
Harpiahealth.com | Reprodução Solução Delfos Mamografia, da Harpia: apoio ao diagnóstico de exames de imagem (à esq.). Aplicativo Neonpass, da Hoobox, voltado à gestão hospitalar (à dir.)Harpiahealth.com | Reprodução
“Hoje a rastreabilidade do paciente e do visitante é feita por diferentes ferramentas tecnológicas, cada uma com seus requisitos e que muitas vezes não se comunicam de forma adequada”, diz Paulo Pinheiro, sócio-fundador da startup. Um problema gerado por essa situação é o paciente precisar informar seus dados de identificação na recepção e depois ser perguntado em etapas posteriores do atendimento. Além disso, com uma jornada descontinuada, dados de tempo, volume e motivos de visitas, por exemplo, são perdidos, comprometendo os fluxos de atendimento na instituição.
“O Neonpass foi projetado para ser um único barramento que orquestra todas as interações com o paciente, sem perda de dados e com maior eficiência operacional”, descreve Pinheiro. Entre as atividades que podem ser executadas estão o check-in, presencial e on-line, a entrada de visitantes e o uso de terminais de atendimento. O acompanhamento gera informações em tempo real que permitem aos gestores saber quantos pacientes e visitantes estão em cada setor, qual recepção está mais cheia e qual o tempo médio de espera para uma consulta ou procedimento médico.
Um novo módulo que a Hoobox está incorporando ao Neonpass é o Sadia, um sistema que utiliza visão computacional e IA para detectar o risco de queda do paciente no leito e o de úlcera de pressão, que aumenta quando a pessoa passa mais de duas horas na mesma posição. As informações são capturadas por uma câmera no leito e usa técnicas de aprendizado de máquina para identificar o paciente, prever o risco de queda e acionar o devido atendimento da enfermagem.
Além disso, o sistema identifica a categoria de profissional que realiza diferentes procedimentos próximos ao leito, contabilizando o total de horas assistenciais, gerando informações aos gestores hospitalares. A solução segue as diretrizes da Lei Geral de Proteção de Dados (LGPD), o que garante que todos os dados sejam tratados e descartados imediatamente de maneira a assegurar a privacidade dos pacientes. Mais de 100 leitos já são monitorados pelo sistema da Hoobox.
Desafios éticos no horizonte
Algoritmos precisam ser transparentes e evitar preconceito ao auxiliar médicos na tomada de decisão
Ao mesmo tempo que apresenta o potencial da inteligência artificial em melhorar a prestação de atenção à saúde e apoiar o desenvolvimento de medicamentos, a Organização Mundial da Saúde (OMS) alerta sobre a necessidade de os desenvolvedores de soluções colocarem a ética e os direitos humanos no centro de suas preocupações.
O relatório “Ética e governança da inteligência artificial para a saúde”, publicado em 2021, destaca os riscos contidos no uso antiético de dados da saúde, principalmente relacionados a preconceitos que podem ser codificados em algoritmos, a exposição de informações que comprometam a privacidade dos pacientes, aos riscos da cibersegurança e a garantia de transparência, explicabilidade e inteligibilidade dos dados gerados.
“Por maior que seja o índice de acertos de um algoritmo, o risco de erros continua existindo. Para ter uma maior confiabilidade, o algoritmo precisa ser transparente, demonstrar ao médico não apenas uma decisão, mas os fatores que foram considerados para chegar a essa decisão”, diz o clínico Antônio Luiz Pinho Ribeiro, vice-diretor do Centro de Inovação em Inteligência Artificial para a Saúde (Ciia-Saúde), com sede em Belo Horizonte (MG).
O médico obstetra Rodolfo Pacagnella, coordenador na área da saúde do Brazilian Institute of Data Science (Bios), ressalta a importância da representatividade dos dados utilizados para o desenvolvimento dos algoritmos. “Um algoritmo treinado para detectar câncer de pele que use como base dados referentes à população norueguesa vai funcionar adequadamente no Brasil?”, questiona.
Pacagnella destaca a necessidade de os algoritmos serem treinados com dados abrangentes, que contemplem populações com diversos perfis, e o cuidado de se evitar que preconceitos raciais e socioeconômicos contaminem os algoritmos, o que pode gerar distorções que passam despercebidas nas soluções de IA.
Outra preocupação é sobre a coleta dos dados utilizados no aprendizado de máquina. “Um algoritmo treinado com dados perfeitos, coletados em situações ideais em laboratórios acadêmicos, não espelha necessariamente a realidade do sistema de saúde. O programa de IA precisa ser validado em situação real de uso, antes de ser disponibilizado para aplicação comercial. Mas isso nem sempre ocorre”, afirma.
Projetos
1. Bios – Brazilian Institute of Data Science (nº 20/09838-0); Modalidade Centros de Pesquisa em Engenharia (CPE); Convênio MCTI/MC; Pesquisador responsável João Marcos Travassos Romano (Unicamp); Investimento R$ 2.180.218,21.
2. Centro de Inovação em Inteligência Artificial para a Saúde (Ciia-Saúde) (nº 20/09866-4); Modalidade Centros de Pesquisa em Engenharia (CPE); Convênio MCTI/MC; Pesquisador responsável Virgílio Augusto Fernandes Almeida (UFMG); Investimento R$ 1.659.839,04.
3. Classificação molecular de nódulos tireoidianos indeterminados através de microRNA profiling (nº 15/07590-3); Modalidade Pesquisa Inovativa em Pequenas Empresas (Pipe); Pesquisador responsável Marcos Tadeu dos Santos (Onkos); Investimento R$ 832.545,15.
4. Métodos computacionais usando aprendizado de máquina para identificação e classificação automática de nódulos mamários e microcalcificações em exames de mamografia digital (nº 19/16514-0); Modalidade Pesquisa Inovativa em Pequenas Empresas (Pipe); Pesquisador responsável Daniel Aparecido Vital (Harpia);
Investimento R$ 101.040,80.
5. Geração ilimitada de imagens de lesões de pele usando redes generativas adversariais (nº 19/19619-7); Modalidade Bolsa de Doutorado; Pesquisadora responsável Sandra Eliza Fontes de Avila (Unicamp); Bolsista Alceu Emanuel Bissoto; Investimento R$ 267.948,89.
Artigos científicos
RIBEIRO, A. H. et al. Automatic diagnosis of the 12-lead ECG using a deep neural network. Nature Communications. 9 abr. 2020.
LIMA, E. M. et al. Deep neural network-estimated electrocardiographic age as a mortality predictor. Nature Communications. 25 ago. 2021.
SANTOS, M. T. et al. Clinical decision support analysis of a microRNA-based thyroid molecular classifier: A real-world, prospective and multicentre validation study. The Lancet Discovery Science (eBioMedicine). 30 jun. 2022. JUMPER, J. et al. Highly accurate protein structure prediction with AlphaFold. Science. 15 jul. 2021.
Este texto foi originalmente publicado por Pesquisa FAPESP de acordo com a licença Creative Commons CC-BY-NC-ND. Leia o original aqui.
var img = new Image(); img.src=’https://revistapesquisa.fapesp.br/republicacao_frame?id=462306&referer=’ + window.location.href;

